|
De werking van de accu
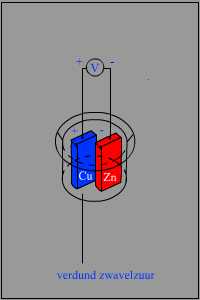
Een galvanisch element (cel) bestaat principieel uit twee geleidende platen (elektroden) uit verschillende materiaal die, zonder dat ze elkaar raken, in een elektrolyt (geleidend zout- of zuuroplossing) geplaatst zijn. Scheikundige werking Onmiddellijk na het inbrengen van een metaalplaat in het elektrolyt ontstaat door de scheikundige werking een spanningsverschil tussen die plaat en het elektrolyt. Tussen een tweede plaat uit het zelfde materiaal en het elektrolyt ontstaat hetzelfde spanningsverschil, zodat tussen beide platen geen spanningsverschil bestaat. Als twee platen uit verschillend materiaal worden geplaatst, dan brengt het elektrolyt de twee platen in een verschillende elektrische toestand t.o.v. het elektrolyt, waardoor tussen de twee platen een potentiaalverschil wordt bekomen. De ene plaat heeft b.v. een hogere spanning t.o.v. het elektrolyt dan de andere plaat waardoor tussen beide platen een potentiaalverschil bestaat. Zo is bij de cel van Volta de spanning tussen de twee platen ca. 1V met de koperplaat positief t.o.v. de zinkplaat. "Stroom" is een elektronenstroom van negatieve plaat naar positieve plaat. De elektronenstroom is dus tegengesteld aan wat we aanduiden met elektrische stroom. De elektronenstroom loopt van het minst edele metaal (in het plaatje Zink) naar het edelere metaal (in het plaatje Koper). Na verloop van tijd zullen de elektronen in het Zink "op" zijn en allemaal zijn gestroomd naar het Koper. In de dagelijkse praktijk is onze accu leeg en aan vervanging toe. Proeven hebben aangetoond dat het opgewekte potentiaalverschil tussen de twee platen afhankelijk is van het soort elektrolyt en het soort metaal waaruit de platen vervaardigd zijn. Zo zijn, naargelang de gebruikte materialen, verschillende typen van cellen gebouwd. Wat is het verband met ons schip? In het verhaal over randaarde lijkt het veilig om de romp van ons metalen schip rechtstreeks te verbinden aan de aardedraad die meegeleverd wordt in de walstroomstekkerdoos. Echter, als we dit zouden doen dan zouden we een heel grote accu creeren.
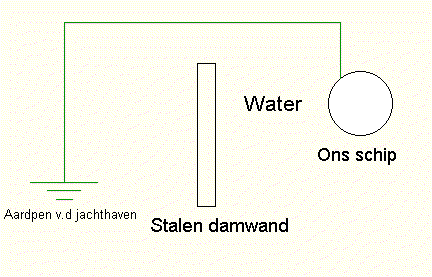
De stalen
damwand is, elektrisch gezien, rechtstreeks verbonden
met de aardpen van de jachthaven en is het edele
metaal. Het elektrolyt is het (zee)water. Ons schip is
het minder edele metaal. Voor verdere uitleg zie het
verhaal over de accu. Ons schip zou wegrotten! 3
mogelijke oorzaken In dit
artikel gaan we in op de problemen die kunnen ontstaan
door de combinatie van randaarde (vanaf de
walstroomkabel) en een stalen schip en de mogelijke
oplossingen daarvan. In dit artikel blijven de 2
andere mogelijke veroorzakers van galvanische corrosie
buiten beschouwing. |